C.B.T.
LIC. JULIAN DIAZ ARIAS
MATERIA:
SUBMODULO 3 PRACTICA Y APLICA ANALISIS MICROBIOLOGICOS EN AGUA, ALIMENTOS Y VINO.
PROFESOR (A):
BEATRIZ LARRAURI RANGEL
“TINCION DE LEVADURAS Y MOHO”
EQUIPO: 5
INTEGRANTES:
MAYRA CAMPOS ÁLVAREZ
JAQUELINE ELIZABETH MEJÍA DÍAZ
NANCY MARTÍNEZ GARCÍA
MARICRUZ NORIEGA PIZARRO
ÁNGEL JONATHAN ORTIZ SÁNCHEZ
MARCOS PUENTES SALGUERO
YEIMI JOCELIN RODRÍGUEZ MATA
VALENTÍN TORRES PERALTA
Melisa Vera Villegas
Aimé Vidal Domínguez
INTRODUCCION
¿QUE SON LAS LEVADURAS?
Se denomina levadura a cualquiera de los diversos hongos microscópicos unicelulares que son importantes por su capacidad para realizar la descomposición mediante fermentación de diversos cuerpos orgánicos, principalmente los azúcares o hidratos de carbono, produciendo distintas sustancias.
A veces suelen estar unidos entre sí formando cadenas. Producen enzimas capaces de descomponer diversos sustratos, principalmente los azúcares.
Una de las levaduras más conocidas es la especie Saccharomyces cerevisiae. Esta levadura tiene la facultad de crecer en forma anaerobia[1] realizando fermentación alcohólica. Por esta razón se emplea en muchos procesos de fermentación industrial, de forma similar a la levadura química, por ejemplo en la producción de cerveza, vino, hidromiel, aguol, pan, producción de antibióticos, etc.
Las levaduras se reproducen asexualmente por gemación o brotación y sexualmente mediante ascosporas o basidioesporas. Durante la reproducción asexual, una nueva yema surge de la levadura madre cuando se dan las condiciones adecuadas, tras lo cual la yema se separa de la madre al alcanzar un tamaño adulto. En condiciones de escasez de nutrientes las levaduras que son capaces de reproducirse sexualmente formarán ascosporas. Las levaduras que no son capaces de recorrer el ciclo sexual completo se clasifican dentro del género Candida.
¿Qué es el moho?
El moho es un hongo que se encuentra tanto al aire libre como en interiores. Existen muchas especies de mohos que son especies microscópicas del reino fungi que crecen en formas de filamentos pluricelulares o unicelulares.
Crecen mejor en condiciones cálidas y húmedas; se reproducen y propagan mediante esporas. Las esporas del moho pueden sobrevivir en variadas condiciones ambientales, incluso en extrema sequedad, si bien ésta no favorece su crecimiento normal.
MATERIAL:
1 microscopio
1 asa de inocular
5 porta objetos
5 cubre objetos
1 mechero bunsen
1 soporte
1 anillo metálico
2 vasos de precipitado
1 termómetro
1 rejilla de asbesto
1 espátula
1 balanza
1 agitador
1 pizeta
1 microscopio
1 asa de inocular
5 porta objetos
5 cubre objetos
1 mechero bunsen
1 soporte
1 anillo metálico
2 vasos de precipitado
1 termómetro
1 rejilla de asbesto
1 espátula
1 balanza
1 agitador
1 pizeta
COLORANTES
Verde malaquita
Cristal violeta
Azul de metileno
Verde malaquita
Cristal violeta
Azul de metileno
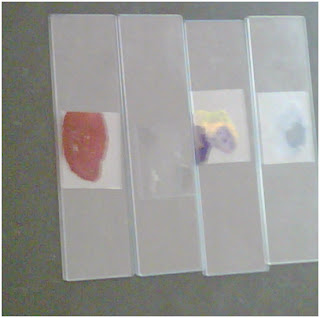
DESARROLLO
1.- Poner a calentar agua a una temperatura de 36° a 37°c manteniéndola a esa temperatura.
2.- Agregar la levadura
3.- Colocar una gota de la levadura en el porta objetos y realizar tinción fija.
4.- Colocar una gota de agua destilada en el porta objetos y tomar una muestra de moho de tortilla.
5.- Realizar tinción fija.
6.- Para realizar la tinción se agregara una gota de agua destilada en el centro del porta objetos, se agregara el colorante, se retiraran restos del colorante y se pasara por el mechero, se le colocara el cubre objeto s.
7.- Se enfocara al microscopio para ser enfocado y así poder observar.
1.- Poner a calentar agua a una temperatura de 36° a 37°c manteniéndola a esa temperatura.
2.- Agregar la levadura
3.- Colocar una gota de la levadura en el porta objetos y realizar tinción fija.
4.- Colocar una gota de agua destilada en el porta objetos y tomar una muestra de moho de tortilla.
5.- Realizar tinción fija.
6.- Para realizar la tinción se agregara una gota de agua destilada en el centro del porta objetos, se agregara el colorante, se retiraran restos del colorante y se pasara por el mechero, se le colocara el cubre objeto s.
7.- Se enfocara al microscopio para ser enfocado y así poder observar.